Ikvienam būtu jāzina, kā atrast vielas masu
Skolas ķīmijas kurss ir ievadspiemaksa sarežģītā zinātnē. No paša sākuma studenti cenšas saprast, kā risināt dizaina problēmas. Pirmajos posmos viņiem ir mazs praktisks pielietojums, bet, ja students ir iemācījies, kā atrast reaģējušo vielu masu, tad viņš var pieprasīt nopietnus sasniegumus.

Apsveriet vienkāršu uzdevuma piemēru, kura pamatā irko jūs varat iemācīties risināt sarežģītāk. Pieņemsim, ka oglekļa monoksīda (II) pilnīgai sadegšanai jums vajag 11,2 litrus. Cik daudz gramu CO2 jūs nokļuvāt?
1. Mēs formulēsim reakcijas vienādojumu.
CO + O2 = CO2
2. Izlīdzināt skābekli. Pastāv noteikums, kas vairumā gadījumu var jums palīdzēt. Sāciet sakārtot koeficientus no šīs vielas, kuras atomu skaits ir nepāra. Šajā gadījumā CO molekulā ir skābeklis. Uz to mēs likt koeficientu 2. Tā kā kreisajā pusē tika izveidoti divi oglekļa atomi, un labajā pusē ir viens, tad mēs ievietojam 2 pirms CO2. Tādējādi iegūstam:
2CO + O2 = 2CO2
Kā redzat, kreisajā un labajā daļā ir četri skābekļa atomi. Ogleklis ir līdzsvarots. Tāpēc viņi sauca pareizi.

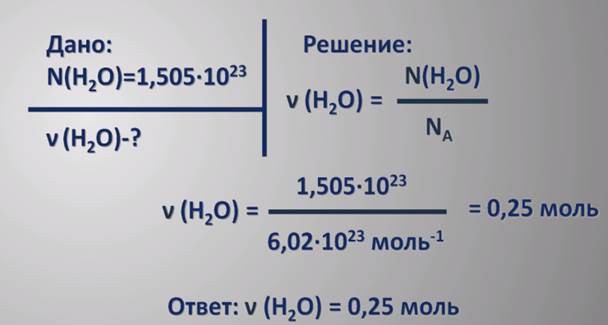
3. Pēc tam atrodiet O2 numuru. Molekulmasu noteikšana skolēniem ir pārāk apgrūtinoša un grūti atcerēties, tāpēc mēs izmantosim atšķirīgu metodi. Atcerieties, ka ir molārs tilpums, kas ir 22,4 litri / mol. Jums jāatrod, cik daudz molu (n) reaģēja: n = V / V m. Mūsu gadījumā n = 0,5 mol.
4. Tagad veido daļu. Reakcijas rezultātā iegūtais skābeklis ir puse no n (CO2) daudzuma. Tas izriet no fakta, ka 0,5 mol / 1 = x mol / 2. Vienkārša abu daudzumu attiecība palīdzēja izveidot pareizo vienādojumu. Kad mēs atradām x = 1, mēs varam saņemt atbildi uz jautājumu par to, kā atrast masu.
5 Patiesībai sākumā būs jāatceras vēl viena formula: m = M * n. Pēdējais mainīgais tika atrasts, bet ko darīt ar M? Molāra masa ir eksperimentāli noteikta vērtība attiecībā pret ūdeņradi. To apzīmē ar burtu M. Tagad mēs zinām, ka m (CO2) = 12 g / mol * 1 mol = 12 g. Tātad, mēs saņēmām atbildi. Kā redzat, nav nekas sarežģīts.

Šī problēma ir diezgan vienkārša attiecībā uz komplektuciti. Bet galvenais ir saprast, kā atrast masu. Iedomājieties kādas vielas molekulu. Ir sen zināms, ka mols sastāv no 6 * 10 ^ 23 molekulām. Tajā pašā laikā periodiskajā tabulā ir noteikta elementa masa uz molu. Dažreiz ir nepieciešams aprēķināt vielas molāro masu. Pieņemsim, ka M (H20) = 18 grami / mol. Tas nozīmē, ka viena ūdeņraža molekula ir M = 1 grams / mol. Bet ūdenī ir divi H atomi. Neaizmirstiet arī par skābekļa klātbūtni, kas dod mums vēl 16 gramus. Apkopojot, mēs iegūstam 18 gramus / mol.
Pēc masas teorētiskais aprēķins būspraktiski pielietot. Jo īpaši tiem studentiem, kuri gaida ķīmisko darbnīcu. Nebaidieties no šī vārda, ja jūs mācāties nepilna laika skolā. Bet, ja ķīmija ir jūsu pamatteksts, labāk nevadīt pamatjēdzienus. Tātad, tagad jūs zināt, kā atrast masu. Atcerieties, ka ķīmijā ir ļoti svarīgi būt konsekventai un piesardzīgai personai, kura ne tikai zina dažus algoritmus, bet arī zina, kā tos pielietot.
</ p>