Kāds ir jautājuma apjoms un kā tas tiek noteikts?
Parunāsim par to, kāds vielas daudzums,jo termins tiek izmantots dabaszinātņu cikla priekšmetos. Tā kā kvantitatīvajām attiecībām ķīmijā un fizikā tiek pievērsta nopietna uzmanība, ir svarīgi zināt visu daudzumu fizisko nozīmi, to mērvienības un piemērošanas jomu.

Apzīmējums, definīcija, mērvienības
Ķīmijā - kvantitatīvaattiecības. Vienādojumu aprēķināšanai tiek izmantoti speciāli aprēķini. Lai saprastu, kāds ir vielas daudzums ķīmijā, mēs sniegsim terminu definīciju. Tas ir fizisks daudzums, kas raksturo analogu strukturālo vienību skaitu (atomos, jonos, molekulās, elektronos), kas atrodas materiālā. Lai saprastu, kāds ir jautājuma daudzums, mēs atzīmējam, ka šim daudzumam ir savs apzīmējums. Veicot aprēķinus, kas paredz šī daudzuma izmantošanu, izmantojiet burtu n. Mērvienības ir mol, kmol, mmol.
Vērtības vērtība
Astotais greideris, kas vēl nezina, kā rakstītķīmisko vienādojumu, nezinu, kāds ir vielas daudzums, kā izmantot šo vērtību aprēķinos. Pēc iepazīšanās ar vielas masas pastāvības likumu, šī daudzuma nozīme kļūst skaidra. Piemēram, sadedzinot ūdeņus skābekļa reakcijā, reaģentu attiecība ir divas līdz viena. Ja ir zināms ūdeņradis, kas ievadīts procesā, ir iespējams noteikt ķīmiskajā reakcijā iesaistītā skābekļa daudzumu.
Formulu piemērošana vielas daudzumamļauj samazināt attiecību starp sākotnējiem reaģentiem, vienkāršot aprēķinu. Kāds ir vielas daudzums ķīmijā? No matemātisko aprēķinu viedokļa tie ir stereochemiskie koeficienti, kas noteikti vienādojumā. Tos izmanto, lai veiktu noteiktus aprēķinus. Veids, kā aprēķināt molekulu skaitu, ir neērts, tas ir izmantotā mola. Izmantojot Avogadro numuru, var aprēķināt, ka 1 mols jebkura reaģenta satur 6 · 1023 molu-1.

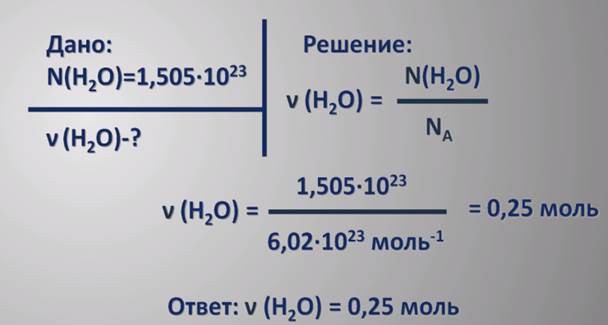
Aprēķini
Vai vēlaties saprast, kāds ir jautājuma apjoms? Fizikā šis daudzums tiek izmantots arī. Tas ir nepieciešams molekulārajā fizikā, kur aprēķina gāzu vielu spiedienu un tilpumu saskaņā ar Mendeļjeva-Klaijersona vienādojumu. Lai veiktu jebkādus kvantitatīvus aprēķinus, tiek piemērota molārās masas koncepcija.
Zem tā nozīmē masu, kasatbilst vienam konkrētas ķīmiskās vielas molekam. Nosakiet molārās masas caur relatīvās atomu masas (to summa, ņemot vērā molekulas atomu skaitu) vai ar zināmu masas masu, tās daudzumu (mol).
Neviens skolu ķīmijas kursa uzdevums nav saistīts araprēķini pēc vienādojuma nav pilnīgi, neizmantojot tādu terminu kā "vielas daudzums". Izmantojot algoritmu, jūs varat tikt galā ne tikai ar parastajiem programmatūras aprēķiniem, bet arī ar sarežģītiem olimpiādes uzdevumiem. Papildus aprēķiniem, izmantojot masas masu, ar šī koncepta palīdzību ir iespējams arī veikt aprēķinus ar molārā tilpuma palīdzību. Tas ir svarīgi gadījumos, kad mijiedarbībā piedalās gāzveida vielas.
</ p>


