Uzlādējiet akumulatora ķēdi un darbības principu
Kā notiek akumulatora uzlāde? Vai šīs ierīces ķēde ir sarežģīta vai nav, lai ierīci padarītu sevi? Vai automašīnas akumulatora uzlādes ierīce principā atšķiras no tā, kas tiek izmantots mobilajiem tālruņiem? Mēs centīsimies atbildēt uz visiem raksta jautājumiem.
Vispārīga informācija
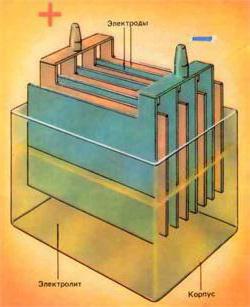
Akumulatora uzlādes, ķēdes un darbības principiŠī ierīce tiek uzskatīta pat skolas fizikas kursā. Bet, diemžēl, daudzas no šīm zināšanām jau ir aizmirsušas atbrīvot. Tādēļ mēs paātrinām atcerēties, ka akumulators ir balstīts uz sprieguma (potenciāla) atšķirības starp divām plāksnēm, kuras ir īpaši iegremdētas elektrolīta šķīdumā.
Pirmās baterijas bija vara-cinka. Bet kopš tā laika tie ir būtiski uzlaboti un modernizēti.
Kā akumulators ir sakārtots

Mēs atgriešanās pie ķermeņa. Tam ir izvirzītas stingras prasības. Tāpēc tam jābūt:
- izturīgs pret agresīviem ķīmiskiem reaģentiem;
- spēj izturēt ievērojamas temperatūras svārstības;
- kam ir labs vibrācijas pretestības indekss.
Visas šīs prasības atbilst mūsdienu sintētiskajam materiālam - polipropilēnam. Sīkāka atšķirība ir jāuzsver tikai tad, ja strādā ar konkrētiem paraugiem.
Darbības princips

Ja terminālī ir slodze, tā sākasnotiek ķīmiskā reakcija, ko papildina elektroenerģijas izlaide. Laika gaitā akumulators tiks izlādēts. Un kā tas tiek atjaunots? Vai ir vienkārša shēma?
Akumulatora uzlādēšana nav grūti. Ir nepieciešams veikt reverso procesu - elektroenerģiju pielieto termināliem, atkārtojas ķīmiskās reakcijas (tiek atjaunots tīrs svins), kas nākotnē ļaus izmantot akumulatoru.
Arī lādēšanas laikā palielināsieselektrolīta blīvums. Tādējādi akumulators atjauno sākotnējās īpašības. Jo labāk tehnoloģijā un materiālos, ko izmanto ražošanā, jo vairāk akumulatora uzlādes / izlādēšanas ciklu var izturēt.
Kāda veida elektriskās ķēdes uzlādēšanas baterijas ir?

Klasiskā ierīce ir izgatavota no taisngrieža un transformatora. Ja mēs uzskatām visas vienas un tās pašas automašīnas akumulatorus ar spriegumu 12 V, tad par tiem maksa ir nepārtrauktā strāva apmēram 14 V.
Kāpēc tā? Šis spriegums ir nepieciešams, lai strāva varētu iziet caur izlādētu automašīnas akumulatoru. Ja viņam pašam ir 12 V, tad tā paša jaudas ierīce nespēs viņam palīdzēt, tāpēc viņi ņem augstākas vērtības. Bet visur, kas jums jāzina, pasākums: ja jūs pārspīlētu spriegumu, tas nelabvēlīgi ietekmēs ierīces darbību.
Tādēļ, ja vēlaties izveidot ierīci ar savām rokām,Automašīnām ir nepieciešams meklēt piemērotas shēmas automobiļu akumulatoru uzlādēšanai. Tas pats attiecas uz citām metodēm. Ja jums ir nepieciešams litija jonu akumulatora uzlādes ķēde, tad jums ir nepieciešama 4 V ierīce un ne vairāk.
Atgūšanas process
Pieņemsim, ka jums ir akumulatora uzlādes ķēdeno ģeneratora, uz kura ierīce tika samontēta. Baterija ir pievienota, un atkopšanas process sākas nekavējoties. Kā tas turpinās, ierīces iekšējā pretestība palielināsies. Ar to lādēšanas strāva samazināsies.
Kad spriegums tuvojas maksimālajai iespējamai vērtībai, šis process parasti nedarbojas vispār. Tas norāda, ka ierīce ir veiksmīgi uzlādēta un to var izslēgt.
Tehnoloģiskie ieteikumi

Ir nepieciešams kontrolēt akumulatora strāvubija tikai 10% no tās jaudas. Un nav ieteicams pārsniegt šo skaitli, ne arī samazināt to. Tātad, ja jūs ejat pa pirmo ceļu, elektrolīts iztvaiko, kas būtiski ietekmēs maksimālo jaudu un akumulatora darbības laiku. Otrajā ceļā nepieciešamie procesi nenotiks nepieciešamā intensitāte, tāpēc negatīvie procesi turpināsies, kaut arī mazākā mērā.
Uzlādēšana
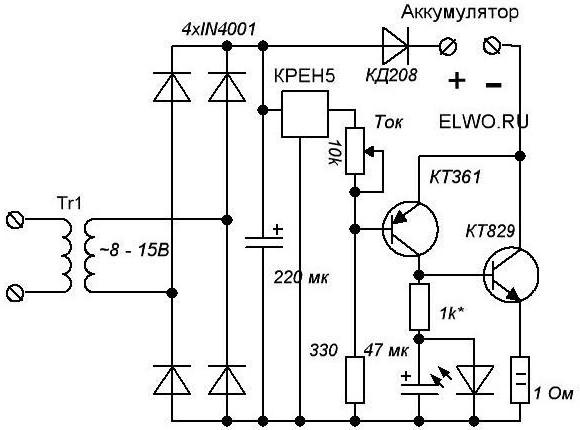
- Strāvas ierobežotājs (paredzēts balastamkondensatori un transformators). Jo vairāk indikatoru var sasniegt, jo nozīmīgāks būs pašreizējais rādītājs. Parasti tam vajadzētu būt pietiekamai, lai uzlādētu. Bet šīs ierīces uzticamība ir ļoti zema. Tātad, ja jūs pārtraucat kontaktus vai kaut ko sajaucat, tad gan transformators, gan kondensatori neizdosies.
- Aizsardzība "nepareizu" stabu savienojuma gadījumā. Lai to izdarītu, jūs varat izveidot relay. Tātad nosacītā virkne pamatojas uz diodi. Ja jūs sajaucat plusus un mīnusus, tad tas nepārsniegs strāvu. Un, tā kā relejs ir savienots ar to, tas tiks atvienots no sprieguma. Un šo shēmu var izmantot ar ierīci, kuras pamatā ir gan tiristori, gan tranzistori. Savienojiet to ar vadu spraugu, caur kuru lādēšana pati tiek pievienota akumulatoram.
- Automatizācija, kas jāuzlādēakumulators. Šajā gadījumā shēmai ir jānodrošina, ka ierīce darbosies tikai tad, ja patiešām ir vajadzīga. Lai to izdarītu, vadības diodes darbības slieksnis mainās ar rezistoru palīdzību. Tiek uzskatīts, ka 12 V baterijas ir pilnīgi, ja to spriegums ir 12,8 V. Tādēļ šis rādītājs ir vēlams šai shēmai.
Secinājums

Raksta ietvaros jūsu uzmanība tika pievērstadažādas shematiskas shēmas, kas skaidri parāda, kā faktiski tiek uzlādētas baterijas. Bet ir jāsaprot, ka tie ir tikai vispārīgi attēli, un sīkāka informācija par ķīmiskajām reakcijām ir īpaša katram akumulatora tipam.
</ p>


